太阳成集团tyc234cc胡良海教授与普渡大学癌症研究中心陶纬国教授合作,开发了一种高通量阵列探针用于外泌体高效捕获和蛋白标志物的原位检测。2023年2月7日以题为“Supramolecular Exosome Array for Efficient Capture and In Situ Detection of Protein Biomarkers”的封面文章发表于ACS出版社的Analytical Chemistry。

外泌体是一种细胞分泌的囊泡状结构小体,广泛存在于血浆、尿液等各种体液中,外泌体蛋白质组成及其翻译后修饰与疾病的发生发展有着密切的联系。由于受到磷脂双分子层膜的保护,外泌体中蛋白质的修饰形态更为稳定,因此能够更精确反应机体的生理和病理状态,是疾病标志物筛选的理想来源。由于外泌体在复杂生物样本中的丰度较低,现有的外泌体的分离方法不能满足于大量临床样本分析的需求,基于此,胡良海教授课题组发展了一种两亲性超分子探针,该探针通过与外泌体双分子层膜之间的多价相互作用形成超分子复合物,从而实现了微量临床样本中外泌体的高效捕获。

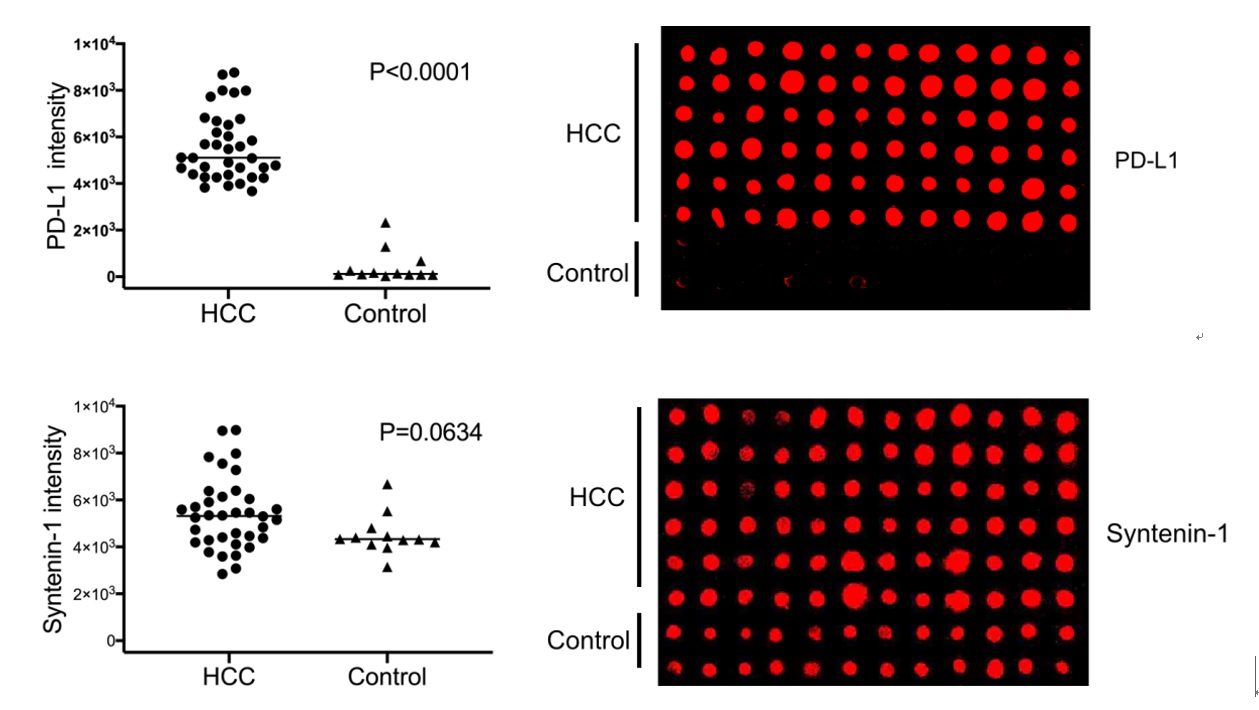
研究团队以36例肝癌患者和12例健康对照的血浆样本进行了外泌体的阵列捕获和原位免疫印迹检测。以程序性细胞死亡配体1(PD-L1)和外泌体标志蛋白Syntenin-1为例,仅用1 μL的血浆样品,即可实现外泌体蛋白质标志物的高灵敏度、高通量检测,所发展的分子探针为肿瘤的早期诊断提供了新的分子工具。
论文第一完成单位为太阳成集团tyc234cc,第一作者为太阳成集团tyc234cc2021级博士研究生冯馨,太阳成集团tyc234cc胡良海教授与普渡大学陶纬国教授为论文的共同通讯作者。本研究得到了国家自然科学基金、吉林省科技厅项目和“人体蛋白质组导航计划”(π-HuB“慧眼计划”)种子项目“肝癌外泌体标志物的队列蛋白质组学筛选与高通量阵列分析”的资助。
全文链接:https://pubs.acs.org/doi/10.1021/acs.analchem.2c04190
胡良海研究团队还应Elsevier出版社的TrAC邀请撰写了题为Single-cell extracellular vesicle analysis by microfluidics and beyond的综述论文一篇,总结了基于微流控芯片及相关技术的单细胞外泌体研究进展,并对单细胞和单颗粒外泌体在肿瘤异质性研究中的应用前景进行了展望。论文第一完成单位为太阳成集团tyc234cc,第一作者为太阳成集团tyc234cc2022级博士研究生武光耀,太阳成集团tyc234cc胡良海教授为文章的通讯作者。

全文链接:https://doi.org/10.1016/j.trac.2023.116930