太阳成集团tyc234cc王丽萍教授研究团队联合中国科学院生物物理研究所的高利增教授研究团队以Fmoc-F-F为简约模型,发现组氨酸可以调节Fmoc-F-F的组装行为,诱导酶样催化。相关结果近日发表在Nature Communications上(Histidine modulates amyloid-like assembly of peptide nanomaterials and confers enzyme-like activity. Nature Communications, 2023, 14:5808.)

组氨酸的存在重新排列了Fmoc-F-F的β结构以组装纳米丝,导致活性位点的形成以模拟催化ROS生成的过氧化物酶样活性。在Aβ组装的细丝中也观察到类似的催化特性,这与分子间组氨酸和F-F之间的空间接近性相关。值得注意的是,组装后的Aβ细丝能够诱导细胞ROS升高并损伤神经元细胞,从而深入了解Aβ聚集与阿尔茨海默病之间的病理关系。总之,这些发现强调了组氨酸在发挥酶样催化作用的肽纳米材料的淀粉样组装中作为调节剂的潜力。蛋白质和肽组装成淀粉样蛋白原纤维的能力已被认为与重度神经退行性疾病密切相关。淀粉样组件具有共同的交叉β结构,其中β链段垂直于长纤维。这种类型的组装由主链氢键和侧链相互作用驱动。Aβ是一种典型的可以以交叉β模式组装成淀粉样蛋白聚集体的蛋白质,经常出现在许多神经退行性疾病中,例如AD和帕金森病(PD)。Aβ组装的研究有助于了解AD的发病机制,可能为诊断和干预提供潜在的靶点。
本研究报告氨基酸有可能通过超声静置过程调节Fmoc-F-F在水条件下的组装行为。具体来说,His被发现通过静电相互作用和氢键促进Fmoc-F-F二肽从纳米棒聚集到纳丝中,导致Fmoc-F-F淀粉样组装中的β结构重排。此外,由此产生的Fmoc-F-F(His)细丝表现出过氧化物酶(POD)样活性,催化ROS生成,其中His的咪唑基团作为活性位点。基于对His和F-F二肽相互作用模式的理解,研究发现Aβ1–42肽组装的纳米丝表现出POD样活性,随着聚集时间的延长而增加。重要的是,Alphafold2辅助结构分析表明,His和F-F之间的分子间相互作用有助于活性位点的形成,这可能使Aβ1-42细丝作为纳米酶在生理环境中工作。细胞和体内实验表明,Aβ1-42微丝诱导ROS毒性损伤神经元细胞,这为了解Aβ聚集与AD发病之间的因果关系提供了新的思路。
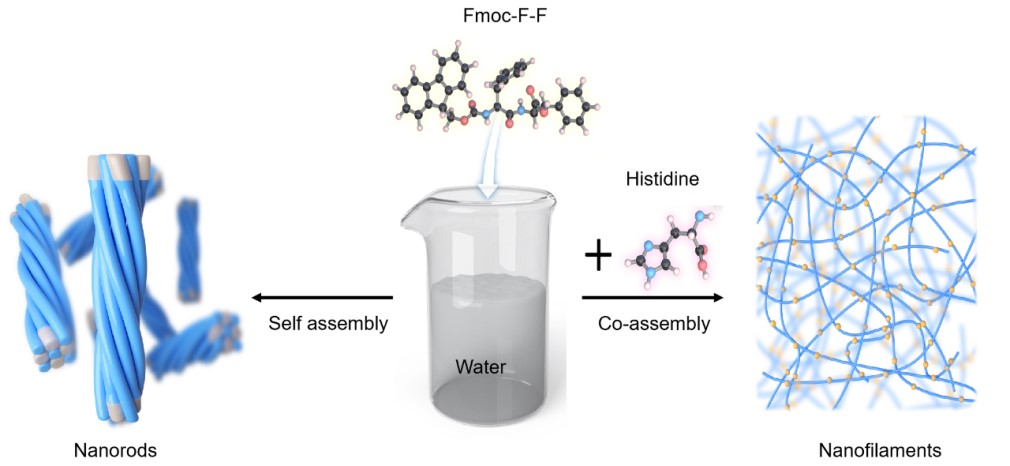
图1 His调控Fmoc-F-F二肽组装示意图
此项研究工作得到了国家重点研发计划、国家自然科学基金创新群体和重点等项目的资助。论文第一完成单位为太阳成集团tyc234cc,第一作者为太阳成集团tyc234cc的博士研究生袁野。太阳成集团tyc234cc王丽萍教授与中国科学院生物物理研究所的高利增教授为论文的共同通讯作者。
论文全文链接https://www.nature.com/articles/s41467-023-41591-1