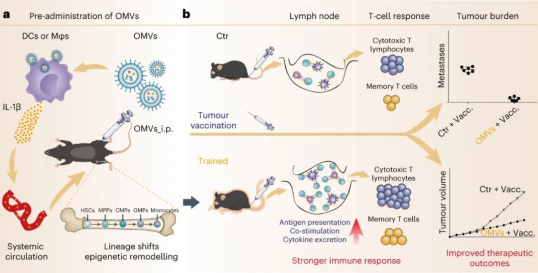
近日,太阳成集团tyc234cc杰出员工、国家纳米科学中心聂广军等研究人员利用含有大量病原体相关分子模式的细菌源性外膜囊泡进行预疫苗接种,进而增强肿瘤疫苗效果。
研究人员将大肠杆菌来源的外膜囊泡(OMV)通过腹腔注射方式免疫小鼠,验明了免疫原性与安全性。预先施用 OMV 显著增强了抗原呈递细胞对后续肿瘤疫苗的反应。
对经OMV训练再接种肿瘤疫苗的小鼠淋巴结中的树突状细胞 (DC) 和巨噬细胞 (Mφ) 进行转录组测序。结果显示 与未经OMV训练组相比,OMV训练组免疫相关途径,包括补体激活、体液免疫反应、对细菌的防御反应、适应性免疫反应和抗原结合等出现了正向富集。
随后,该研究深入探讨了OMV对造血细胞表型和表观遗传重塑的影响。骨髓分析显示OMV 训练组小鼠造血祖细胞亚群发生变化,多能祖细胞 (MPP) 和偏向骨髓的 MPP3 亚群增加;骨髓祖细胞 (MyPs) 和粒细胞巨噬细胞祖细胞 (GMPs) 增加,而共同骨髓祖细胞 (CMPs) 减少。OMV促进骨髓分化同时,还在祖细胞中印记了表观遗传变化,从而在随后的肿瘤疫苗接种过程中,抗原呈递细胞 (APC) 能更高效地行使功能。
OMV能被先天免疫细胞快速摄取,而无需进入骨髓。OMV预给药后,炎症细胞因子(尤其是IL-1β)的血清水平显著升高。IL-1受体拮抗剂(IL-1RA)或中和抗体能逆转OMV诱导的造血祖细胞变化,比如骨髓分化偏向;降低肿瘤疫苗接种反应。这些发现强调了 IL-1β 在OMV 免疫调节中的关键作用。
经OMV 处理的骨髓来源细胞显示出显著的 IL-1β合成增加。抑制NLRP3炎性小体或caspase-1可减少OMV诱导的IL-1β 分泌削弱OMV介导的免疫增强效应。
OMV 表面的脂多糖 (LPS) 激活caspase-11相关的非典型炎症小体,导致K+流出和典型 NLRP3 炎症小体激活。进一步研究发现,抑制OMV 内吞可减少 IL-1β分泌。游离 LPS 预给药也无法影响后续的肿瘤疫苗接种效果。在caspase-11 敲除小鼠中,OMV则缺乏对肿瘤疫苗的增强作用。上述实验对OMV介导的免疫增强效应机制进行了详细论证。
最后,研究人员评估了OMV对免疫系统抗肿瘤活性的影响。在体内肿瘤模型中,预先施用OMV显著提高了后续肿瘤疫苗接种的治疗效果。OMV 组小鼠在接种肿瘤疫苗后表现出更高的抗原特异性 T 细胞活化水平,更强的细胞毒性作用以及增多的肿瘤浸润性 CD8+T 细胞。经过 OMV 训练的小鼠中效应 T 细胞和中枢记忆 T 细胞明显增多,从而增强对肿瘤的长期抵抗力,减缓肿瘤生长,并延长小鼠生存期。
图|OMV增强肿瘤疫苗免疫活性
总之,研究人员证明向小鼠腹腔注射细菌OMV 可增强肿瘤疫苗的免疫活性。OMV被腹膜内先天免疫细胞内吞,同时将PAMP(特别是LPS)输送到细胞质,从而激活炎症小体信号通路,诱导IL-1β分泌。IL-1β进入骨髓导致造血祖细胞的谱系转变和表观遗传学重塑,最终增强外周APC对肿瘤疫苗的反应性。这种使用源自细菌的天然纳米囊泡来动员先天免疫功能的策略,展示出了积极的临床应用前景。
参考文献:Liu, G., Ma, N., Cheng, K. et al. Bacteria-derived nanovesicles enhance tumour vaccination by trained immunity. Nat. Nanotechnol. (2023).https://doi.org/10.1038/s41565-023-01553-6
聂广军研究员简介

聂广军,1999年于太阳成集团tyc234cc获得硕士学位,2002年于中国科学院生物物理所获得博士学位,之后在加拿大McGill大学从事博士后研究。中科院特聘研究员,国科大特聘教授;科技部纳米研究国家重大科学研究计划(973)项目首席科学家(2012-2016),国家重点研发计划首席科学家(2018-2022);国务院享受政府特殊津贴专家;基金委创新群体、中科院创新交叉团队、中科院卢嘉锡国际团队成员;2016年获中国药学会以岭药业青年科学家奖,美国Houston Methodist Research Institute(休斯敦)兼职教授,英国医学科学院Advanced Newton Scholar;中国生物物理学会常务理事,中国抗癌协会纳米肿瘤学专业委员会委员,中国药学会纳米药物专业委员会委员;国家纳米科学中心科技处处长;Nano Letters 副主编。
在Nature Biotechnology, Nature Biomedical Engineering, Nature Communications, Blood, JACS, JBC, Angew Chem Int Ed, Adv Mater, Nano Letters, ACS Nano, Adv Funct Mater, Biomaterials, Haematologica, Brit J Haematol, Antioxid Redox Sign, Cancer Letters, Small和Nanomedicine等发表论文140余篇;申请抗肿瘤应用等相关发明专利40余项(授权中国专利20余项,美国授权专利3项,日本专利1项,专利转让2项)。相关研究成果被Nature Biotechnology, Nature Materials, Nature Biomedical Engineering, Nature Reviews of Cancer, Science Translational Medicine和Blood等进行了重点推荐和报道。